Marcadores no invasivos para fibrosis hepática
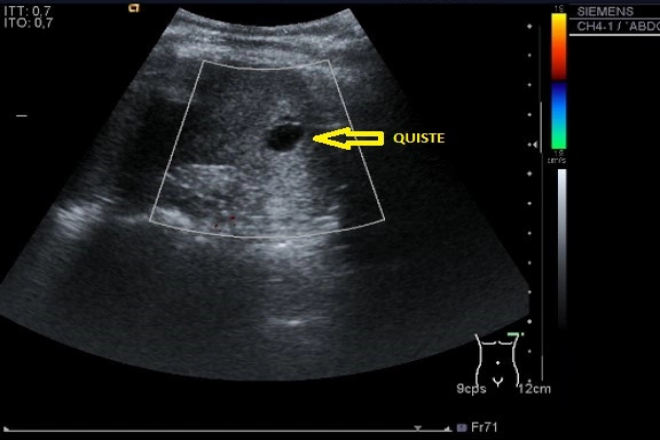
La fibrosis hepática se define como la acumulación de matriz extracelular en el hígado, lo que eventualmente afecta su estructura y función. En todas las etapas de la fibrogénesis, se observa una activación del sistema inmune y un aumento de citoquinas y factores de crecimiento, que promueven la fibrosis. En un ambiente fibrótico, la regeneración celular constante puede predisponer al desarrollo de carcinoma hepatocelular. A pesar de su impacto disruptivo, la fibrosis hepática, incluso en estadios avanzados como la cirrosis precoz, puede revertirse mediante la supresión de la respuesta fibrótica.
Biología de la fibrosis hepática
Los miofibroblastos (MF) son las células más relevantes en la producción de matriz extracelular. Diversos tipos celulares, incluyendo células hepáticas y de la médula ósea, pueden convertirse en MF fibrogénicos. Los hepatocitos y colangiocitos pueden activarse para funcionar como MF a través de la transición epitelial-mesenquimal (EMT). Durante el daño hepático, se producen especies reactivas de oxígeno y se desencadena apoptosis en hepatocitos, mientras que los macrófagos hepáticos inician una respuesta inmunológica masiva que recluta células inflamatorias al sitio de lesión. Este proceso involucra la liberación de mediadores pro-inflamatorios y pro-fibróticos, como citoquinas y factores de crecimiento.
Las células estrelladas hepáticas (HSC) quiescentes se activan y contribuyen a la quimiotaxis de leucocitos a través de la producción de diversas moléculas. En estadios avanzados de la fibrosis, se observa un incremento significativo de componentes de la matriz extracelular en el hígado, como colágeno y proteoglicanos.
Artículo escrito por la Dra. Hilda Morales